生命と糖鎖は密接にかかわっています。生物体の器を構築する「構造糖鎖」、生体内の情報伝達を司る「機能糖鎖」、生命のエネルギー源である「貯蔵糖鎖」など、生命と糖鎖は不可分な関係性にあります。ナノ・バイオテクノロジーの著しい発展から、機能糖鎖に関する生命科学研究が盛んに行われています。また、食・環境・エネルギーの課題解決に向け、貯蔵糖鎖の増産やバイオエネルギー開発なども重要です。しかし、構造糖鎖については、建材、繊維・紙、安価な高分子材料など、旧来的なバルク・化成品利用がほとんどでした。
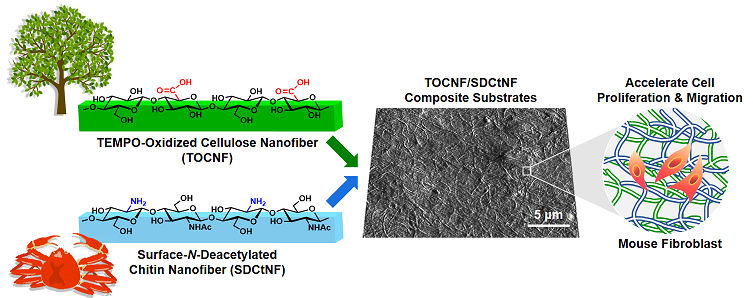
近年、循環型生物資源の主役であるセルロースをはじめとする構造多糖の規則的な高次構造に注目が集まっています。これらの生体高分子集合体は、生命情報の伝達などの能動的な生理機能には関与しないと考えられてきましたが、生体内において自己組織化・自己集合化に重要な役目を果たしており、精緻な高次構造を構築することが明らかになりつつあります。バイオマテリアル班(B班)では、構造多糖のナノ構造そのものを「生命に働きかける機能」として利用するために、そのナノファイバー形状や規則的な糖鎖界面構造に着目したバイオマテリアルの開発を行っています。具体的には、以下の4つの研究テーマに取り組んでいます。
森と海の構造多糖ナノファイバーで動物細胞を育てる
構造多糖ナノファイバーを用いるバイオアダプティブ細胞培養基材の開発
生体内の細胞は、細胞外マトリックス(ECM)に取り囲まれており、ECMの主成分はコラーゲンなどの線維状タンパク質や、ヒアルロン酸などの多糖類です。生体内に近い状態で細胞培養を行うために、ECMを模倣した培養基材の開発が世界中で行われています。
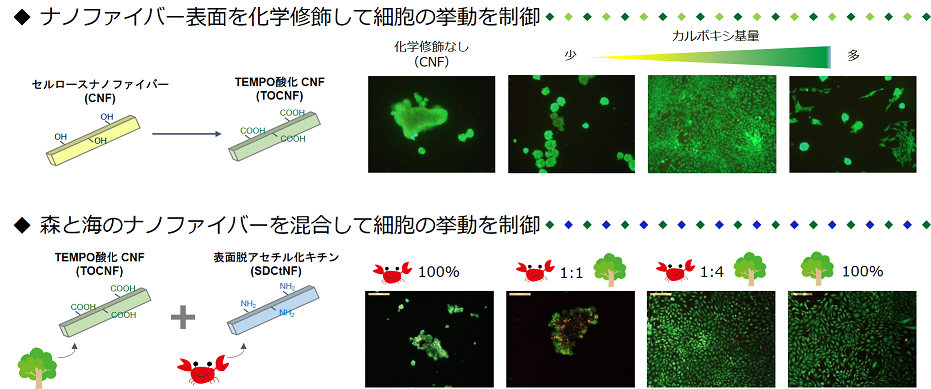
私たちは、樹木由来のセルロースナノファイバーや、エビやカニから得られるキチンナノファイバーなどの多糖ナノファイバーを使って、ECM模倣環境を作り出すことに挑戦しています。セルロースナノファイバー上で細胞を培養すると、細胞は丸まって凝集してしまいますが、ファイバーの表面にカルボキシ基を導入すると、導入量に応じて細胞が良好に接着・増殖することを発見しました。さらに、キチンナノファイバーの表面をキトサンに変えた、表面脱アセチル化キチンナノファイバーと混ぜ合わせると、混合比率によって細胞の接着性や細胞遊走性が変化することも明らかにしました。創傷被覆剤や幹細胞培養基材などの再生医療分野での応用に期待が持たれます。
ナノファイバーで包まれた“空間”が細胞機能を制御する
ピッカリングエマルション鋳型法による3D細胞培養基材の開発
生体組織は3次元構造を持っており、その生育には細胞接着・増殖・生存に直接働きかける細胞周辺の微小環境の再構築が必要です。多糖類は、細胞を取り囲む3D環境のビルディングブロック(部品)として盛んに研究されてきましたが、マイクロメートルサイズの空隙(細胞サイズ)をナノメートルサイズのナノファイバーで精密に構造制御するのは困難でした。
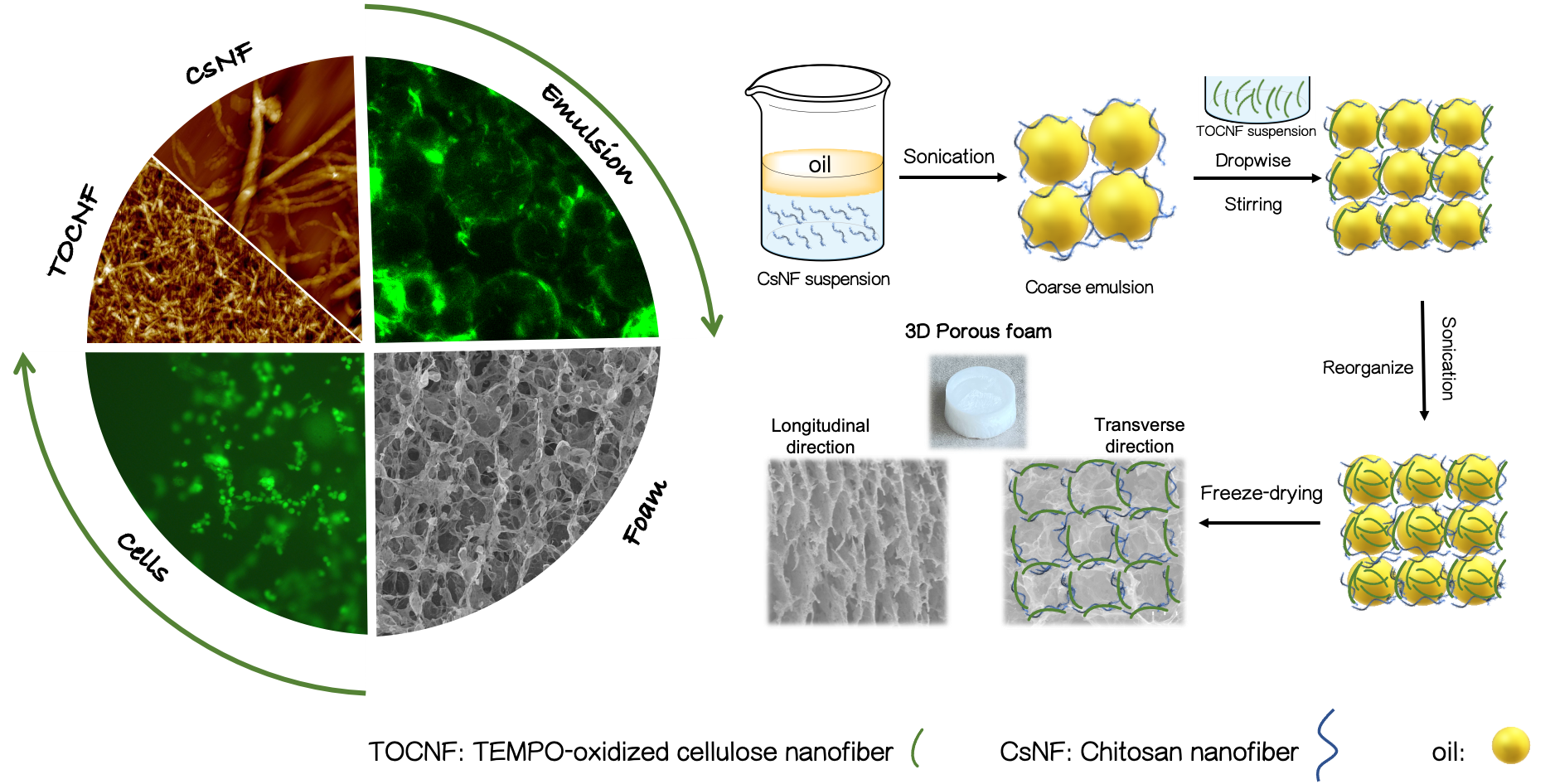
本研究では、樹木由来のセルロースナノファイバーや甲殻類由来のキチンから作られるキトサンナノファイバーが、両親媒性のナノ固体界面を有することに着目し、水と油を石鹸で分散させたようなエマルション(固体界面活性剤を用いる場合は、ピッカリングエマルションと呼びます)を形成させることで、大きな空隙を有する3D細胞培養基材の開発に成功しました。ヒト肝臓細胞の培養で高い解毒酵素活性を発現させるなど様々な細胞機能の制御が可能であり、今後、創薬やバイオメディカル分野での応用に期待がもたれます。
多糖ゲルのソフトな硬さが細胞生育環境を制御する
細くて硬い結晶性多糖ナノファイバーからなるソフトゲル基材の開発
細胞外マトリックス(ECM)は、ナノファイバーで構成されたゲル状の構造体であり、生体内において細胞の適切な機能発現をサポートしていると考えられています。例えば、肝臓細胞の多様な機能は細胞が立体的な構造をとることで、その多様で複雑な機能を発揮しています。造血幹細胞は、ECMの硬さによって、休眠状態と活性化された状態がスイッチすることが知られています。これらの細胞は薬物代謝スクリーニングや、再生医療への応用が期待されており、生体外での細胞培養の需要が高まっています。
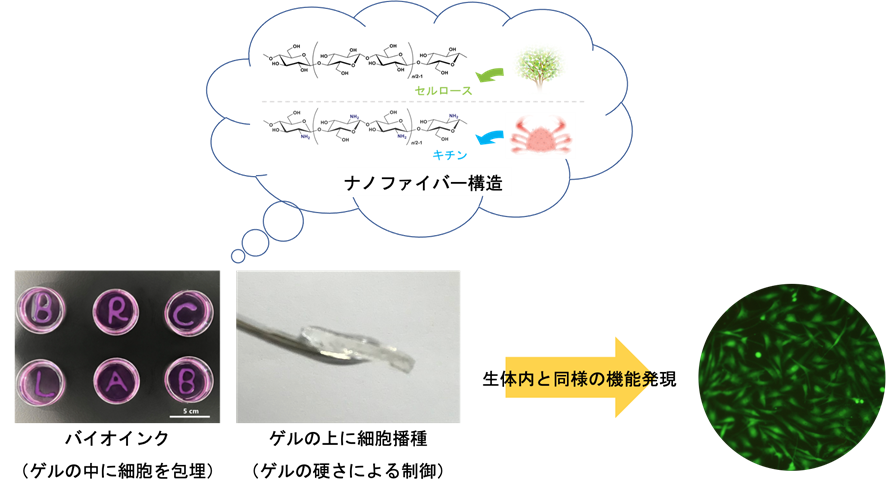
本研究では、セルロースナノファイバーやキチンナノファイバーを使って、ECMの物理的構造を模倣した細胞培養ゲル状基材の開発に挑戦しています。高分子ゲルとは異なり、細くて硬い結晶性の多糖ナノファイバーからなる“しっかりした硬さの柔らかいゲル”を用いて、ゲル基材上またはゲル中で様々な細胞を育てることで、生体外培養での機能発現と制御を目指しています。
構造多糖界面への官能基導入で細胞分化を制御する
生体構成要素の構造模倣戦略に基づく細胞分化制御基材の開発
細胞外マトリックス(ECM)は、細胞の増殖・分化に関与することが明らかになっています。例えば、骨組織のECM中の主成分はコラーゲンと無機リン酸カルシウムですが、その構造を模倣することで、損傷した骨組織の再生が期待されます。また、多糖ECMには硫酸化されたグリコサミノグリカンが普遍的に存在しており、細胞の接着や分化、成長因子の作用などに関わりがあることから、再生医療分野で注目されています。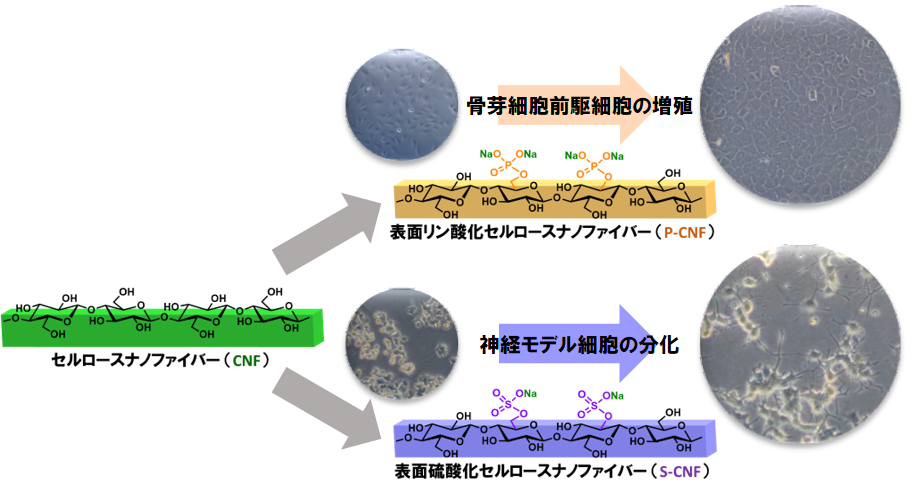 本研究では、ナノセルロースにリン酸基や硫酸基などの官能基を導入することで、分子構造とナノ構造の両面からECMの構造模倣を試みています。官能基を導入した結晶性ナノセルロース基材上で様々な動物細胞を培養し、増殖や分化の制御・誘導を目指しています。Xeno-free(免疫原性の動物成分を含まない)バイオアダプティブ細胞培養基材の開発が期待されます。
本研究では、ナノセルロースにリン酸基や硫酸基などの官能基を導入することで、分子構造とナノ構造の両面からECMの構造模倣を試みています。官能基を導入した結晶性ナノセルロース基材上で様々な動物細胞を培養し、増殖や分化の制御・誘導を目指しています。Xeno-free(免疫原性の動物成分を含まない)バイオアダプティブ細胞培養基材の開発が期待されます。


